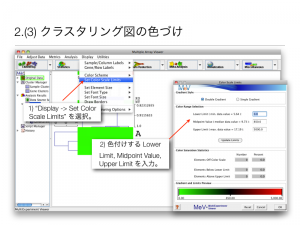
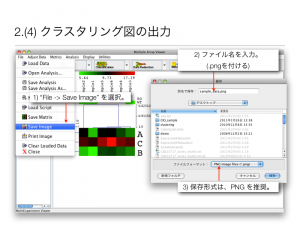
ratio を用いた発現変動遺伝子の判定の問題点
前回、ratio を用いた発現変動遺伝子の判定基準を述べました。また、下記の3つの問題点を挙げました。今回は、それらの問題点への対策を述べます。
- しきい値ギリギリの遺伝子。 (1.9倍に増加している場合など)
- シグナル値が低く、 ratio は高い遺伝子。 (10 から 100 に増加した場合など。)
- シグナル値が高く、 ratio が低い遺伝子。 (40,000 から 60,000 に増加した場合など。)
問題1. しきい値ギリギリの遺伝子(1.9倍に増加した遺伝子など)
前回、発現変動遺伝子を判定する条件として、2倍(0.5倍)という、しきい値を挙げました。このとき、1.9倍に増加した遺伝子は、発現変動遺伝子と判定されません。わずかの差で発現変動遺伝子とならないのは、惜しい気がします。この場合、どうしたらいいのでしょうか?
解決策1: 「あきらめる」
解決策の1つは、「あきらめる」です。仮に1.9倍もOKとした場合、1.8倍はどうするのか?1.8倍もOKなら、1.7倍は、、、とキリがありません。必ず、どこかで線引きが必要になります。1.9倍は、なにも発現変動しなかったと言っているわけではありません。いったん、2倍という基準を用いて、その後の解析を行って、それから次点の発現変動遺伝子の候補を探しても遅くはないでしょう。また、発現変動遺伝子の判定基準を低く設定すると、新たな問題が発生します。それは、発現変動遺伝子と判定される遺伝子の数が多すぎるという問題です。発現変動遺伝子の数が数千個となった場合は、その後の解析に支障が出ます。(詳しくは別で述べます。)
解決策2: 「ratio 以外の判定基準を使用」
別の解決策としては、「ratio 以外の判定基準を使用する」というものが考えられます。これは、次の問題点の解決策でもあるので、次で述べます。(p-value や Z-score などがあります。)
解決策3: 「他の実験結果をつける」
論文投稿時であれば、リアルタイムPCRなど「他の実験結果をつける」という方法もあります。特定の遺伝子の発現変動の有無に注目されている場合、その特定の遺伝子の ratio が、しきい値以上になっていなければ気になる方も多いと思います。前回、述べたように、判定基準の2倍という数字に根拠はありません。そのため、ほかの実験で確認できているのであれば、1.9倍であっても、1.5倍であってもレビュワーから問題にされることは少ないです。
解決策4: 「正規化のアルゴリズムを変更する」
別の解決策としては、「正規化のアルゴリズムを変更する」というものです。異なるアルゴリズムを用いて正規化を行えば、正規化のシグナル値は、若干、異なる値となります。うまくいけば、あるアルゴリズムで正規化したときに 1.9 倍の増加であった遺伝子が、別のアルゴリズムで正規化されたときに2倍の増加になるかもしれません。ただ、この方法だと、すべての遺伝子のシグナル値に影響があるため、逆のことも起こります。2倍の増加であったものが、1.9倍の増加になるかもしれません。注目しているすべての遺伝子に都合良く、正規化できるアルゴリズムが存在するとは限りません(遺伝子ごとに正規化方法を変えることはできません)。この方法は、いささか、恣意的な行為と考えられるため、奥の手と言えます。
結論1
いくつかの問題点はありますが、 ratio で判定すること自体がイケナイわけではありません。(問題があることを理解した上で判定するのであれば。)また、1度、決めたら判定基準に従うのが無難です。しきい値ギリギリの遺伝子は諦めるのをお勧めします。必ず、どこかで線引きが必要になります。さらに、最近の論文では、マイクロアレイデータだけでは認められず、ほかの実験(リアルタイムPCRなど)の結果も求められることが多いです。そのとき、ほかの実験で結果が出ていれば、ratio の大きさは、あまり問題にされません。いずれにしろ、ほとんどのマイクロアレイデータでは、相当数(数百から千個程度)の遺伝子が発現変動遺伝子と判定されますので、まずは、それらの明らかに変動している遺伝子を中心に結果を見ていくのがよいでしょう。(あえて、微妙な変動を示す遺伝子にこだわる理由があれば別ですが。)
つづきます。